Chemischer Hintergrund
Polymerisation:
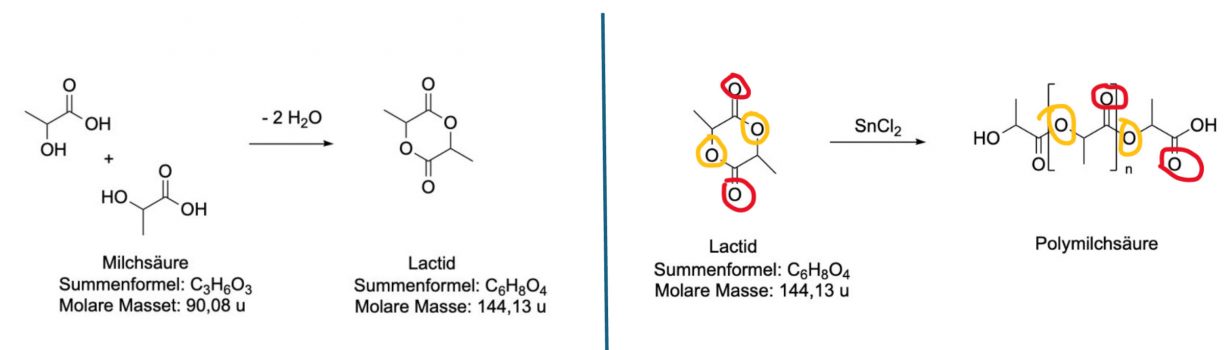
Wenn zwei Milchsäuremoleküle miteinander reagieren, verbindet sich die Hydroxylgruppe (-OH) eines Milchsäuremoleküls mit der Carboxylgruppe eines anderen Milchsäuremoleküls. Dabei entsteht ein Ring, der Lactid genannt wird, und es wird Wasser (H20) frei.
Wenn man die Mischung erhitzt, öffnen sich diese Lactid-Ringe. Die geöffneten Ringe können dann miteinander reagieren und lange Ketten bilden. Dieser Prozess wird als Ringöffnungspolymerisation bezeichnet. Damit diese Reaktion schneller abläuft, wird ein Katalysator verwendet. In diesem Fall ist es Zinn-(II)-chlorid (SnCb), ein typischerLewis-Säure Katalysator.
Polymilchsäure (PLA) wird zum Beispiel für 3D-Drucker oder Verpackungen verwendet und ist im Gegensatz zu erdölbasierten Kunststoffen aus einem nachwachsenden Rohstoff.
Katalysator:
Ein Katalysator ist ein Stoff, der eine chemische Reaktion beschleunigt, ohne selbst verbraucht zu werden. Er senkt die Energie, die benötigt wird, damit die Reaktionüberhaupt starten kann. Dadurch läuft die Reaktion schneller ab, aber die Eigenschaftendes Endprodukts ändern sich nicht.
Lewis-Säure-Katalysator:
Ein Lewis-Säure-Katalysator ist ein spezieller Katalysator, der in der Lage ist, Elektronenpaare von anderen Molekülen aufzunehmen. Diese Fähigkeit hilft, Moleküle zu aktivieren und verschiedene chemische Reaktionen zu beschleunigen.




